ҒЫЛЫМ FACES — проект, цель которого представить казахстанских ученых — разного пола и возраста, живущих в Казахстане и за рубежом, представителей самых разных направлений науки, объединенных любовью к научным исследованиям.
Юлия Сафарова (девичья фамилия Янцен) — выпускник программы «Болашак», обучалась в Новой Зеландии. Уже 9 лет она работает в Назарбаев Университете над проектом по использованию стволовых клеток для восстановления костной ткани. Юлия и ее коллеги успешно провели исследования на клетках и лабораторных животных и убедились, что их технология готова к клиническим исследованиям и, возможно, поможет в заживлении переломов у пациентов с остеопорозом. О важности международного сотрудничества, о доступе к статистическим данным, а также о том, что необходимо Казахстану, чтобы начать клинические исследования клеточной терапии, мы поговорили с Юлией Сафаровой (Янцен).
Асель: Как прошло твое детство?
Юлия: Родилась я в Костанае в семье врачей. Мои родители, дядя и тетя, бабушка и дедушка — все врачи. Я росла в медицинской среде, ночевала с родителями на дежурствах, поэтому просто обожаю больницы, в них я чувствую себя как дома. Уже со второго класса я знала, что буду поступать на медицинский. А потом в седьмом классе у нас появилась строгая учительница по английскому языку Елена Васильевна. За два-три года я подтянула английский и начала участвовать в олимпиадах.
Асель: Как ты попала в Новую Зеландию?
Юлия: Многие мои одноклассники стремились уехать учиться в российские вузы, никто не знал про стипендию «Болашак». О ней узнал мой папа, в общем-то, и подала я ради него. Я буквально за неделю собрала документы. Одновременно с этим я все-таки поступила в Медицинский Университет Астаны (МУА) и проучилась там два семестра. Помню, что когда я проходила IELTS, о структуре теста узнала прямо там. Моим выбором номер один была Англия: честно говоря, на слуху из иностранных вузов в Костанае были только Оксфорд и Кембридж. Но вскоре мне сказали, что набор в Англию уже закрыт. То же самое произошло с Сингапуром. Кроме того, оказалось, что отправить меня могут только на программу биомедицины, так как обучение на медицинском в западных странах происходит после бакалавриата по биологии. Я до последнего не хотела уезжать, так как мечтала быть врачом и не совсем представляла, где может работать биолог. Я уже начала практикумы по анатомии в МУА, когда мне позвонили и предложили поехать в Новую Зеландию. Здесь, наверное, на мое решение повлияла мама, чему я очень рада, потому что такой опыт я бы не получила нигде. Вот так я оказалась в первой экспериментальной группе, которая отправилась на учебу в Новую Зеландию. Во время учебы меня больше всего увлекала эмбриология.
Асель: Как ты определяешь сейчас свое направление науки? В чем его красота?
Юлия: Я — клеточный биолог. Через микроскоп я попадаю в мир клеток. Это другой мир, другая реальность, и от этого порой захватывает дух. Красота устройства клетки дает силы работать, учиться дальше и узнавать что-то новое. А это очень важно, потому что работа научного сотрудника у нас только наполовину (а порой и меньше) состоит из экспериментов. Остальное время занимает бумажная работа: заявки на грантовое финансирование, отчеты, закупки и т.д. Поэтому просто жизненно необходимо порой остановиться и вспомнить, зачем я этим занимаюсь.
Асель: С чего начался твой PhD проект?
Юлия: Я пришла в Назарбаев Университет в 2011 году, и почти сразу нас отправили на стажировку в Университет Питтсбурга в Лабораторию химического синтеза, которая разрабатывает органические полимеры для применения в биомедицине. Руководитель проекта в Казахстане — доктор Шолпан Аскарова. В этой стажировке родилась идея использования полимеров с функциональными группами, которые можно применить в клеточной терапии для регенерации костной ткани. То есть наш проект скорее начался с самого метода, применение которому мы нашли при остеопорозе.
Асель: Расскажи об идее проекта в общих чертах.
Юлия: Дело в том, что в связи с увеличением продолжительности жизни, заболевания, присущие людям старшего возраста, встречаются всё чаще и представляют больший риск для населения. К таким заболеваниям относится и остеопороз. Костная ткань истончается и увеличивается риск возникновения перелома даже при небольших ударах. Именно переломы на фоне остеопороза могут в конечном итоге привести к инвалидности.
Асель: Опиши, пожалуйста, как происходит развитие остеопороза на клеточном уровне?
Юлия: В нашей костной ткани постоянно происходят два параллельных процесса — разрушения и восстановления. За разрушение отвечают остеокласты — клетки-поедатели, а за восстановление — остеобласты, клетки, формирующие костную ткань. Есть клетки-предшественники, которые могут становиться остеокластами или остеобластами в зависимости от ситуации. Этот баланс клеток с возрастом сдвигается. Снижается количество клеток-предшественников, они теряют свои реактивные свойства. Если в молодом возрасте они могут быстро сгруппироваться и направиться на место перелома, то с возрастом это всё гораздо сложнее. Совсем избежать эту проблему невозможно, но можно нивелировать. При простых переломах кость заживает хорошо и ничего придумывать не нужно. Но при остеопорозе регенерация нарушена, и костный метаболизм сдвигается в сторону остеокластных процессов с постепенным разрушением костной ткани.
Асель: Какова ваша цель?
Юлия: Наша цель — использовать собственные стволовые клетки человека (незрелые клетки, способные делиться и превращаться в клетки различных органов и тканей — прим. автора), доставить их к костной ткани на место перелома и запустить программу регенерации (восстановления).
Их можно использовать для регенерации практически всех тканей и при различных заболеваниях, но в нашем случае это регенерация костной ткани. Для этого мы используем специальный полимер с бисфосфонатной группой, который прикреплен к клеткам для того, чтобы они были доставлены именно к костной ткани. Наш проект состоял из нескольких стадий: выбор полимера, in vitro исследования (in vitro = «в пробирке», в данном случае исследования на клеточных линиях) и in vivo — исследования на лабораторных животных.
Асель: Очень важно рассказать нашим читателям, что любая биомедицинская разработка проходит этот долгий путь от идеи, к клеткам и животным, а если повезет, и к клиническим исследованиям. Давай подробнее опишем этот путь. Для начала, расскажи, пожалуйста, про полимеры, которые вы использовали.
Юлия: Полимеры мы синтезировали на базе Университета Питтсбурга, в лаборатории Алана Рассела, которая позже перешла в Университет Карнеги Меллон. Они использовали метод ATRP — новый метод синтеза органических полимеров, так называемый метод радикальной полимеризации с помощью переноса атома, изобретенный Кристофом Матишевски в середине 90-х (научная статья, описывающая это открытие, была процитирована более 5000 раз, а сам ученый удостоился множества наград — прим. автора). Существуют различные методы полимеризации. В данном случае традиционно используется метод пегелирования, но он не позволяет контролировать количество функциональных групп, то есть, получаются случайные полимеры-генерики, а использованный нами метод ATRP позволяет получать полимеры с известным количеством функциональных групп. За счет этого он более надежный и прогнозируемый. Мы точно будем знать, сколько бисфосфонатных групп, сколько гидроксильных групп присутствует в полимере.
Асель: А теперь давай подробнее опишем культуру клеток. Кстати, можно ли у нас купить коммерческие готовые линии стволовых клеток?
Юлия: Клеточные линии мы пока не можем покупать. Компании, производящие клеточные культуры, не работают с посредниками, а мы напрямую работать не можем из-за правил госзакупок. Поэтому клетки мы выделяем сами, это клетки крысы. Затем мы проверяем их на антитела, сортируем. Всё это, конечно, гораздо затратнее, особенно в плане времени и проверки качества продукта.
Асель: Получается, с клетками человека вы не работаете?
Юлия: Наша лаборатория не работает с человеческими клетками. У нас полностью животная модель. Но сейчас у нас есть новое здание и две лаборатории, одна из которых по техническим параметрам готова для работы с человеческими клетками в будущем. Там есть всё для обеспечения безопасности. Надо понимать, что это практически единственная такая лаборатория в стране. Тем не менее, у нас есть клиники, работающие с клетками человека, но всё, что у них есть из оборудования, — это ламинарный шкаф. Из-за того, что нет регламента и регулирующего законодательства, возможна и такая практика. Мне, как человеку, на которого были потрачены бюджетные деньги для того, чтобы научиться использовать клеточные технологии правильно, важно, чтобы мы начали двигаться в сторону составления процедур и высоких стандартов безопасности.
Асель: Тогда затронем вопрос закупок. Я помню, что 7 лет назад, когда я работала в Назарбаев Университете, биологам приходилось ждать до полугода, чтобы закупить реагенты и оборудование. Изменилась ли эта ситуация?
Юлия: Я думаю, что прогресс есть. Но закупки по-прежнему могут занять от 3 до 6 месяцев. Нужно собрать километры бумаг, всех убедить, почему мне нужен определенный реагент, согласовать, подписать. Могут несколько раз переспросить «а вам это точно нужно?». Конечно, нельзя не заметить контраст: в Питтсбурге ты просто отправляешь заявку по электронной почте, и на следующее утро реагент уже у тебя на столе. За счет того, что все производится на месте и логистика в США просто на потрясающем уровне, возможны такие сроки доставки.
Иногда из-за этого настигает отчаяние: ну как мы, казахстанские ученые, сможем хоть как-то с ними конкурировать? Когда я вернулась из последней стажировки, я очень долго отходила. У нас полгода приходится ждать, и иногда привезут и выясняется, что хранили неправильно. Тут нужно отметить, что для клеточных биологов условия хранения и транспортировки реагентов напрямую влияют на качество эксперимента. Но, безусловно, процесс закупок становится лучше, чем был раньше.
Асель: Хорошо. Вернемся к клеткам. Итак, вы используете мезенхимальные стволовые клетки. Почему?
Юлия: Мезенхимальные стволовые клетки — это клетки-предшественники остеобластов. Идея состоит в том, что мы доставим эти клетки и они в последующем дифференцируются (превратятся) в остеобласты.
Асель: Значит, у нас есть культура клеток и полимер с бисфосфонатными группами. Нам нужно, чтобы эти клетки превратились в костную ткань на месте перелома. В чем новизна этого метода?
Юлия: Дело в том, что даже при локальной доставке клетки могут не прижиться, остаться в межклеточном пространстве, может увеличиться риск развития онкологического заболевания. По сути добавление полимера — этот наш способ точечной доставки клеток. Один конец полимера — гидроксильная группа — крепится к клеткам. А другой конец — бисфосфонатная группа — имеет высокую аффинность (степень взаимодействия — прим. автора) к костной ткани. Таким образом, этот полимер целенаправленно должен доставить клетки к поверхности костной ткани. И там происходит волшебство. Этим подходом мы сдвигаем метаболизм и способствуем улучшению регенерации кости.
Асель: А какие у вашей технологии есть риски?
Юлия: Один из рисков клеточных технологий — иммунное отторжение, но в данном случае в клинической перспективе оно не актуально, так как будут использоваться модифицированные полимером клетки самого пациента, взятые либо с жировой ткани, либо из костного мозга (обычно с верхнего гребня подвздошной кости). Но есть риск развития онкологического процесса, в этом потенциальная проблема использования стволовых клеток. При введении мезенхимальных стволовых клеток в общий кровоток есть тенденция их скопления в месте пролиферации (быстрого размножения) клеток. То есть, иными словами, наши клетки пойдут туда, где возникает бесконтрольное размножение клеток, что может привести к развитию рака. Этот фактор — еще одна причина для нашего подхода точечной доставки к месту перелома, чтобы клетки целенаправленно шли к костной ткани. Таким образом, мы значительно снижаем риск развития опухолей.
Асель: Как проходили исследования на клетках?
Юлия: Для того, чтобы протестировать работу полимера, в течение 3-4 лет мы проводили исследования на клеточной линии. Нужно было понять, насколько прочно полимер связывается с клетками костных осколков, есть ли аффинность к костной ткани и т.д. Мы также проверили, что он держится на клетках в течение 4 часов, что бисфосфонатная активность сохраняется, что он подавляет рост остеокластов и не влияет на дальнейшую пролиферацию клеток.
Асель: Какие эксперименты вы проводили на животных?
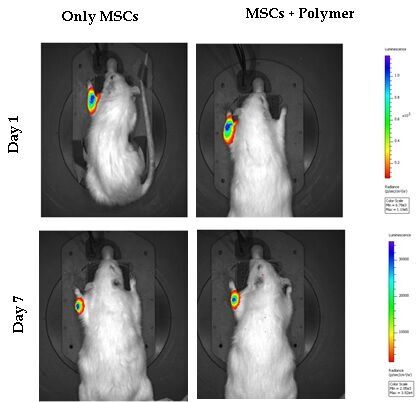
Юлия: Мы моделировали остеопороз на крысах: измеряли костную плотность, индуцировали переломы, вкалывали клетки и производили замеры. Для этих экспериментов мы метили клетки люминесцентным вектором и использовали их для инъекций. Таким образом, мы могли их наблюдать на микрокомпьютерном томографе со специальным видеоустройством и увидели, что клетки скапливаются в участке перелома. Эти эксперименты были утверждены комиссией по биоэтике. Работа с животными всегда интересная и тяжелая одновременно. Всё-таки за время работы привыкаешь даже к крысам, и выводить их из эксперимента, пусть даже очень гуманно, порой нелегко. Кстати, после того, как я стала мамой, я стала к этому более чувствительной, исчезло хладнокровие, и в будущем я хотела бы ограничиться только молекулярными исследованиями без участия животных.
Асель: Результаты исследований были опубликованы?
Юлия: Да, исследования на клетках были опубликованы частично в 2014 году и дополнены в 2020 году. Исследования на животных готовятся к публикации.
Асель: Итак, вы довели проект до отличного результата в лаборатории — 9 лет работы на клеточных линиях и на крысах. Что дальше? Продолжится ли проект в клинических исследованиях?
Юлия: Это вопрос, который мы часто слышим от журналистов: когда же технология будет доступна пациентам? Так как я не врач, у меня как у научного сотрудника нет доступа к клиникам, у меня нет медицинского образования, я ограничена своей лабораторией. Я могу довести свое исследование только до определенного этапа. Изначально при Назарбаев Университете планировалась интегрированная академическая система, где вместе работали бы университет, лаборатории и клиники. В клиниках использовали бы наши технологии как экспериментальное лечение и дальше бы регистрировали. Я до своего уровня проект довела, а дальше должны подключаться клиники. За рубежом дальше обычно подключаются фармкомпании, их R&D департаменты.
Асель: Почему так мало исследований доходит до клиники? Понятно, что клинические исследования требуют инвестиций, они дорогостоящие во всем мире. Есть ли ещё какие-то специфические для Казахстана проблемы в этой отрасли?
Юлия: В нашем конкретном случае основная сложность состоит в том, что нет закона о биомедицинских клеточных продуктах и непонятно, как их регистрировать. Нет регламента, по которому должны проводиться процедуры с клетками. Но несмотря на это, клеточная трансплантация у нас проводится, но проходит она по коду «Высокоспециализированная медицинская помощь», что не совсем соответствует специфике такой работы. В некоторых больницах, например, есть клеточный департамент, они колют клетки. Я, честно говоря, отношусь к этому не совсем положительно, потому как у нас нет единой законодательной базы. Каждая больница делает это на свое усмотрение, согласно своему собственному регламенту, и клиницисты не сильно вникают в суть клеточных процессов, что меня огорчает.
Асель: А что мешает нам создать этот регламент?
Юлия: Закон висит в разработке, но он не в приоритете. Нам нужны активисты, которые бы продвигали изменения на законодательном уровне.
Асель: Как мы представляем себе этот регламент?
Юлия: В нем должно быть прописано, что после обработки клеточного материала необходимо убедиться, что есть такие-то маркеры и только при наличии таких маркеров можно вводить продукт. По факту у нас сейчас колют все, что угодно. В России уже приняли закон два года назад. Биомедицинский клеточный продукт может быть 3 видов: немодифицированные клетки, генетически модифицированные клетки и поверхностно-модифицированные клетки. Когда мы задумывались о регистрации и обсуждали этот вопрос с НЦЭЛС («Национальный центр экспертизы лекарственных средств и медицинских изделий»), мы поняли, что зарегистрировать мы можем только сам полимер, а не метод модификации клеток. Но проверять сам полимер не имеет смысла, так как мы его модифицируем и его свойства меняются. А клетки браться должны у самого пациента. В этом и есть большая загвоздка, для чего как раз-таки и нужен отдельный регламент по клеткам.
Асель: Если мы планируем использовать в будущем такие блага цивилизации, как генетическое редактирование CRISPR для терапии, мы ведь должны начинать готовить наше законодательство, хотя бы на уровне использования клеточной терапии. Мы часто видим, и особенно это касается медицины, что законодательство не успевает за развитием технологий. И это не только казахстанская проблема. Почему это так сложно?
Юлия: Для примера, возьмем США. Регистрация в FDA занимает длительное время, и на сегодняшний день зарегистрировано только 10 клеточных продуктов. У нас в стране разработок не так много, лаборатории находятся в основном в Алматы и Нур-Султане. Из-за этого мало специалистов, которые могли бы грамотно сформулировать и подготовить регистрационные документы. То же самое касается и медицинского страхования и медицинских судов. Где-то за рубежом есть отдельные медицинские суды, мы же от этого очень далеки.
Асель: А какие данные в стране по остеопорозу?
Юлия: Есть отчет за 2015 год, который был инициирован и спонсировался ВОЗ. Тогда массово проводилась денситометрия (измерение плотности костной ткани). Но в последние годы мы просто берем общую статистику ВОЗ и пересчитываем на население Казахстана. Со статистикой вообще большая проблема. В Институте Развития Здравоохранения есть департамент статистики, где данные собираются, но открыто они не предоставляются. Доступ к данным нужно покупать, что само по себе странно, так как по сути такая информация в обработанном виде должна быть в общем доступе.
Асель: Опасность переломов при остеопорозе подчеркивает важность превентивного подхода. Доступна ли у нас денситометрия (измерение плотности костной ткани) в качестве скрининга?
Юлия: Да, она доступна для людей старше 55 лет. Очень важно сделать акцент на своевременной диагностике и профилактике. Остеопороз — это тихое и незаметное заболевание. О том, что у человека развивается остеопороз, многие узнают уже после перелома. Плотность кости может снизиться на две единицы, но человек продолжает жить обычной жизнью до первого перелома. При остеопорозе кости восстанавливаются гораздо сложнее и дольше. Перелом шейки бедра после 65 лет в большинстве случаев приводит к инвалидности. Замена шейки бедра на имплантат — возможное решение, но процедура дорогостоящая и требует длительной реабилитации. Ухудшается прогноз и качество жизни. Важно отметить, что у женщин остеопороз — это эстроген-зависимое состояние. Как только снижается количество эстрогена, кальций начинает вымываться. Следовательно, обычно развитие остеопороза у женщин прогрессирует во время менопаузы.
Асель: А какие есть варианты лечения?
Юлия: Первое, на что обычно пациенты обращают внимание, — это прием кальция, но это не идеальное решение, ведь усваивается только 50%. Существует гормонозамещающая терапия, но у нее есть свои побочные эффекты, к примеру, она приводит к повышенному риску развития рака груди. Есть также блокаторы рецепторов эстрогена, но у них тоже свои отрицательные побочные действия. Другой выход — бисфосфонатные препараты, которые ингибируют ключевой фермент в метаболизме остеокластов, клеток, которые «поедают» костную ткань, в итоге процесс развития остеопороза замедляется. Однако, пить их нужно постоянно на протяжении 1-2 лет, а также делать перерывы. Побочные эффекты — довольно частое развитие некроза челюсти, именно поэтому людям, принимающим бисфосфонаты, противопоказаны сложные стоматологические операции на время приема лекарств. Кроме того, случаются переломы голени. Остеобласты формируют ткань, а остеокласты поедают ее, резорбируют. Этот процесс должен быть в балансе. Когда мы воздействуем только на одну часть, на остеокласты, тормозим их, это постепенно приводит к уменьшению и остеобластов. То есть все виды лечения на данный момент имеют свои побочные действия.
Асель: Получается, что точечная терапия, которую вы разрабатываете, может помочь исправить эту ситуацию?
Юлия: Опять же, в нашем проекте цель — это скорее устранение последствий, помощь в восстановлении кости в состоянии остеопороза после перелома. На данный момент этот инструмент клеточной терапии с поверхностной модификацией может быть эффективным. Улучшить качество жизни для людей, которые могут остаться инвалидами на всю оставшуюся жизнь, — это очень важно. Для болезней старения основная помощь в этом и состоит — борьба с симптоматикой, улучшение качества жизни.
Асель: Сейчас ты заканчиваешь PhD в Назарбаев Университете. Какие дальнейшие планы?
Юлия: Что касается этого проекта, то надо дождаться момента, когда решится вопрос с законодательством и регистрацией медицинских клеточных продуктов. Я работаю над этим проектом уже 9 лет. Но для ученого важно в какой-то момент уйти в свободное плавание, оторваться от материнского института. Важно выходить из зоны комфорта. Для научного сотрудника особенно важно выезжать, ездить на стажировки за рубежом и смотреть, как система работает там. Сейчас очень много возможностей для этого. Есть, например, Фонд первого президента, Британский совет и Исламский банк развития, которые предлагают гранты, периодически объявляют конкурсы. После защиты я хотела бы попробовать себя в чуть другом направлении, а где именно работать, я пока не знаю, буду пробовать.
Асель: Ты не жалеешь, что не стала врачом?
Юлия: Моя работа всё равно связана с медициной. Врачом в нашей реальности быть очень тяжело. Меня беспокоит, например, привлечение врачей к уголовной ответственности за врачебные ошибки. Я рада быть на стыке науки и медицины. Цепь случайных событий привела меня в науку. И только сейчас, заканчивая PhD, я понимаю, что 10 лет назад, когда я вернулась с учебы домой и думала, что всё могу, я совсем не понимала, что такое наука. Наверное, в этом и весь смысл исследовательской работы.
Асель: А каково быть мамой в казахстанской науке?
Юлия: Быть мамой везде сложно. Для мамы-ученого появляются ограничения в свободе мышления, ведь нельзя всё бросить и записать свои идеи и мысли, когда пришло вдохновение. Маме думать о науке можно только в ограниченные промежутки времени, когда она не занята ребенком. Конечно, у нас в стране мамам, может быть, даже легче работать в науке, так как в нашей культуре сильна поддержка семьи, с детьми могут помочь бабушки и дедушки.
Асель: Каково положение женщины в науке? Чувствуешь ли ты проявление сексизма и эйджизма?
Юлия: У нас в университете нет, но в целом в некоторой степени это есть. Я сталкиваюсь с этим в национальных институтах или во время конференций в России. Мы часто шутим, что на американские конференции можно ездить в шортах и все равно все будут с тобой разговаривать на равных, а у нас на постсоветском пространстве молодым девушкам сложнее, не всегда нас воспринимают всерьез.
Асель: Наш традиционный вопрос. Казахстанская наука: пациент скорее жив или мертв?
Юлия: Конечно, жив! Во многом, это благодаря обновлению кадров. Сначала очень много вернулось бакалавров и магистров, которые видели, как наука работает за рубежом. Сейчас вернулись и молодые доктора PhD. Не хочу как-то обидеть советскую и постсоветскую науку, но нам важно ориентироваться на мировой уровень, особенно в биологии. Сейчас в Назарбаев Университете у нас замечательная база, замечательные лаборатории. Уровень цитируемости наших исследователей становится выше.
Есть небольшая проблема со СМИ. Не подготовлена база журналистов, которые могут писать про биомедицинские исследования. Бывает так, что задают вопросы, а потом пишут, что «казахстанские ученые изобрели эликсир долголетия». Очень не хочется стать «британскими учеными», но для этого нам нужно развивать научную коммуникацию. Но в целом, прозрачность финансирования стала выше. Комитет науки провел большую работу, чтобы перевести заявки в электронный формат, и это на самом деле замечательно. Казахстанская наука жива и ее создают наши ученые!
Автор благодарит Айгуль Шапранову за помощь в подготовке материала.
Поддержите журналистику, которой доверяют.