Первую самостоятельную родственную трансплантацию печени наши врачи провели в 2014 году. Сейчас более трех тысяч казахстанцев стоят в листе ожидания на трансплантацию органа. Проблемам трансплантологии в Казахстане посвящен спецпроект Оксаны Акуловой «Лист ожидания».
Нехватка донорских органов — одна из основных проблем современной трансплантологии. Родственная пересадка печени — практически единственный радикальный метод, позволяющий спасти пациентов с терминальными стадиями заболевания печени в Казахстане. Ожидание подходящего донора может затянуться на долгие годы, и, к сожалению, многие не доживают до операции. Пересадка печени от посмертных доноров увеличивает потенциальный пул донорских органов. Однако для успешной операции необходимо пересадить не только качественный орган, но и успеть это сделать в короткий временной промежуток.
Ермек Нигмет — хирург, доктор медицинских наук и научный сотрудник института трансплантологии им. Томаса Старзла при Университете Питтсбурга. Мы поговорили о том, как «оживить» донорскую печень, о разнице работы в Японии и в США и о том, зачем хирургу заниматься фундаментальной наукой.
Желание быть полезным обществу
Я родился в Семее, но большую часть детства и школьные годы провел у бабушки в районном центре Самар, в Восточно-Казахстанской области. Бабушка посвятила много времени моему воспитанию, и именно она заложила «фундамент», основы ценностей, на которые я равнялся и продолжаю ориентироваться в жизни и карьере. Особое внимание она уделяла личностным качествам и тому, что, несмотря на достижения в карьере, в первую очередь, надо оставаться человеком.
С детства я хотел быть полезным обществу, поэтому после окончания школы поступил в Медицинский Университет Астана. Все студенческие годы, начиная со второго курса, я подрабатывал в хирургическом отделении городской больницы №1. Сначала в качестве санитара, затем медбрата. Все праздничные дни и свободное время проводил на дежурствах в отделении экстренной хирургии. Мне посчастливилось поработать с настоящими профессионалами абдоминальной хирургии (хирургическое лечение заболеваний и органов брюшной полости), такими, как Ускенбаев Талгат Айтбаевич, Абежанова Галия Саркытовна и др. Проработав некоторое время общим хирургом в уже «родном» отделении хирургии, я получил предложение о переквалификации для работы в отделении сосудистой хирургии. Руководителем и основателем отделения является Едил Бакишевич Айтжанов, врач высшей категории, доктор медицинских наук. Едил Бакишевич был одним из первых специалистов, выполнявших вмешательства на сосудах в Астане. Под его руководством мы выполняли многочисленные сложные операции, например, возобновление кровотока (bypass) при таких редких заболеваниях сосудов, как синдромы Такаясу, Лериша и др.
Путь к фундаментальной науке
Интерес к науке зародился во время участия в студенческом научном кружке, но истинный интерес пришел позже, во время обучения на докторантуре в Японии. На последнем курсе университета я всерьез задумался об обучении за рубежом. Тогда я начал собирать информацию об университетах и стипендиях, но на тот момент её было мало. Таким образом, со студенческой скамьи я перешел в хирургическое отделение городской больницы. Рабочие будни молодого специалиста очень насыщены: днем ты курируешь несколько палат, осматриваешь пациентов и проводишь плановые операции, а затем нередко остаешься на ночное дежурство. Конечно, это не всегда легко, но в то же время очень увлекательно. Мы с коллегами могли сутками напролет находиться в операционных. Силы придает чувство выполненного долга и свет в глазах пациента, который идет на поправку.
Когда я работал общим хирургом, у нас часто были пациенты с тяжёлыми поражениями печени (цирроз печени, рак печени), спасти их могла пересадка печени. Но на тот момент трансплантацию печени в Казахстане не проводили, поэтому я решил выбрать это направление и начал время от времени отправлять письма профессорам зарубежных университетов. После нескольких неудачных попыток, пришли приглашения сразу из двух японских университетов: из Хиросимы и Киото.
Киотский Университет (Kyoto University) — один из древнейших, первый в области трансплантации печени и числу Нобелевских лауреатов в Японии, поэтому мой выбор пал на него. Хоть и считается, что первая в мире родственная трансплантация печени проведена в Японии, в госпитале Шимане, профессором Н. Нагасэ, но все-таки «начало» эры родственной трансплантации печени зародилось в Киотском университете. Профессор К. Танака с коллегами разработали протоколы по трансплантации печени с использованием правой доли печени, что расширило так называемый «донорский пул» и сделало эту процедуру стандартным методом лечения больных с терминальной стадией поражения печени. Профессор Ш. Уемото согласился принять меня на годичную стажировку с возможностью участия в конкурсе на поступление в докторантуру. Моя супруга к этому моменту уже была зачислена на магистратуру в Университет Осака. Так мы с женой и маленькой дочерью переехали в Страну восходящего солнца.
Хочу отметить особую роль семьи в моих достижениях. Поддержка родных придает мне силы. Моя супруга и дети своей любовью и поддержкой заряжают огромной энергией для достижения поставленных задач. Также я безмерно благодарен нашим родителям, которые поддерживают нас в любых начинаниях.
Спустя год после успешной сдачи вступительных экзаменов, я был зачислен на программу докторантуры Высшей Школы Медицины Киотского Университета — на специальность гепатобилиарная хирургия и трансплантация печени. После этого я получил возможность получить стипендию «Болашак». Во время стажировки в Университетской клинике, основное время я проводил в операционной; это были длительные и тяжелые, но интересные операции. В Университетскую клинику отправляют пациентов со сложными диагнозами, которым требуется высококвалифицированная медицинская помощь. Также во время стажировки я имел возможность познакомиться с коллегами из разных стран. Запомнился один случай, когда все знакомились и коллега из Тайваня не знал о существовании и месторасположении Казахстана. После того, как я рассказал о нашей республике и показал ее на карте, он с удивлением отметил, что это огромная страна, и извинился. Я же в ответ подарил ему сувенир с традиционным казахским орнаментом.
Во время докторантуры большую часть времени я проводил за экспериментами в лаборатории. Моя научная тема была связана со Статическим хранением (Static Cold Storage, SCS) печени c расширенными критериями (Extended Criteria Donor, ECD) во время трансплантации. К донорам с расширенными критериями относят широкий спектр доноров с неблагоприятными характеристиками, традиционно связанными с худшим состоянием трансплантата и более низкой выживаемостью реципиента. К таким донорам относятся люди старшего возраста, пациенты с различными заболеваниями печени (неалкогольная жировая болезнь печени и др.), с гипернатриемией, после остановки сердца и др. Наиболее распространенный тип печени с расширенными критериями — это печень от пациентов, у которых произошла остановка сердца (Donor after circulatory death, DCD). Трансплантация печени от таких пациентов связана с тяжелыми повреждениями (ишемическим и реперфузионным), которые могут приводить к первичному нарушению функции трансплантата, ишемии желчных путей и другим осложнениям.
Статическое хранение печени — это один из способов. Во время трансплантации печень промывается специальным холодным раствором и хранится в растворе со льдом (4-8 °С) до момента пересадки органа пациенту. В абдоминальной хирургии популярны раствор Висконсинского университета (UW solution) и раствор гистидин-триптофан-кетоглутарат (НТК, Кустадиол). Статическое хранение хоть и создает благоприятные условия для сохранения печени, но такой способ в некоторых случаях приводит к повреждению органа, в особенности если этот орган уже был подвержен каким-либо патологическим изменениям, таким, как жировой гепатоз (когда в клетках печени накапливается жир) или ишемия (местное снижение кровоснабжения, приводящее к временному нарушению функций или повреждению ткани или органа; часто развивается в связи с остановкой сердечной деятельности) и другие. Впоследствии, после пересадки такого органа, мы можем получить печень, не выполняющую свою функцию, в этом случае пациенту требуется повторная пересадка органа в кратчайшие сроки. К сожалению, мы не можем отказаться от использования таких органов из-за их колоссальной нехватки. По статистике, в среднем около 20 пациентов в день умирают в США во время ожидания донорского органа, в Японии это около 1500 пациентов в год.
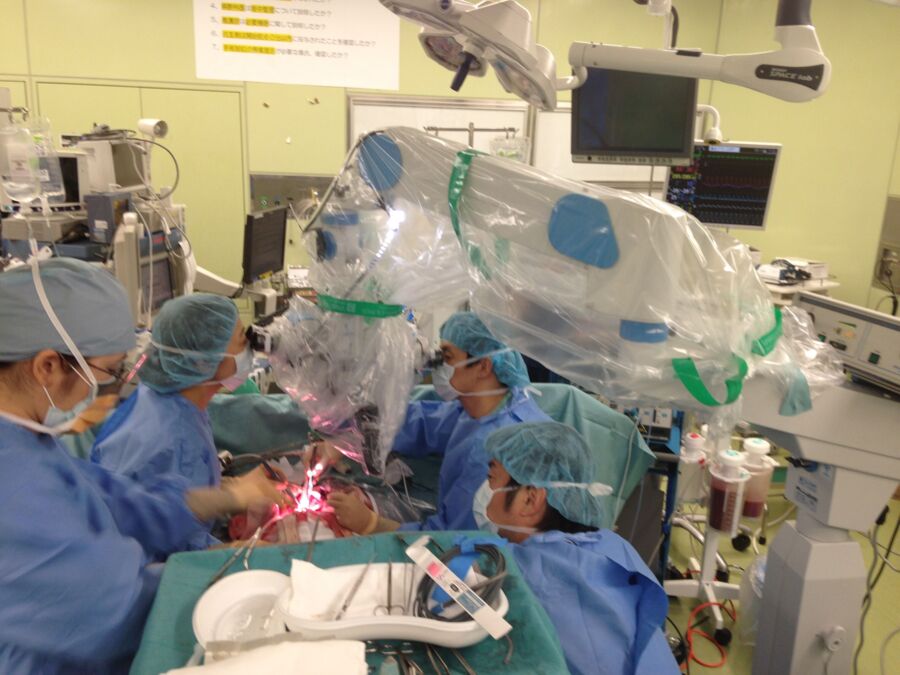
Целью моего исследования было изменить стандартный метод статического хранения печени с расширенными критериями, такими, как от трупного донора с остановкой кровообращения (Donor after circulatory death, DCD). Это даст возможность расширить «донорский пул», что увеличит количество трансплантаций. Печень от трупного донора с остановкой кровообращения подвергается длительной ишемии (отсутствие кровообращения) в среднем 20-30 минут, так как в этот момент происходит остановка сердечной деятельности. Как мы знаем, во время пятиминутного отсутствия кислорода смерть мозга становится неизбежной. Печень — орган с многочисленными сосудами разного калибра от 0.01мм до 5 см, которые, как многочисленные клубочки, соединяются и переплетаются между собой для обеспечения достаточного кислорода и питательных веществ в гепатоциты (клетки печени) и желчные протоки. Полное отсутствие кровообращения ведет к повреждению гепатоцитов и сосудистого эпителия, в конечном счете мы получаем нерабочий орган и осложнения в послеоперационном периоде.
Более того, образовавшиеся тромбы (сгустки крови) внутри сосудистого русла невозможно извлечь во время промывания печени холодным раствором, впоследствии, после имплантации органа пациенту и возобновления циркуляции крови, они (тромбы) препятствуют потоку крови и доставке кислорода гепатоцитам. Это все ведет к необратимым повреждениям печени и неблагоприятному исходу после операции. Наряду с закупоркой кровеносных сосудов, происходит воспалительная реакция. Поэтому медикам при проведении трансплантации тяжело работать с органами, полученными после остановки сердечной деятельности. С целью модификации традиционного метода статического хранения, мы с коллегами решили использовать фармакологические препараты. В Японии, в области кардиологии и онкологии, широко используется препарат под названием «Предсердный натрийуретический пептид человека, hANP». Он обладает определенными свойствами, которые приводят к расширению сосудов и угнетают воспалительную реакцию. Мы предположили, что применение этого препарата могло бы способствовать улучшению качества статического хранения печени. Добавив его в раствор для хранения печени (в нашем случае это раствор Университета Висконсин), мы добились значительного улучшения кровообращения ткани печени и снизили степень воспалительной реакции, тем самым у нас получилось улучшить качество хранения этого органа. Несмотря на то, что этот препарат уже используется в клинической практике (в кардиологии, урологии, в лечения рака легкого), для использования в трансплантологии требуются дополнительные пре-клинические исследования, которые сейчас проводятся нашими коллегами в Японии.
Также во время докторантуры я изучал метод экстракорпоральной перфузии печени (ex vivo perfusion). В клинической практике этот метод не является распространенным, так как требует, во-первых, наличие специально обученного персонала, а во-вторых, существенных финансовых затрат. Только высокоразвитые индустриальные страны могут позволить использование этого метода сохранения печени во время трансплантации.
Перфузия органов ex vivo увеличит количество доступных органов для трансплантации
Как я уже говорил, традиционно донорские органы промывают холодным раствором (р-р Университета Висконсин, Кустадиол) и хранят в таком же растворе со льдом до тех пор, пока они не будут пересажены. Однако, при экстракорпоральной перфузии (или перфузии ex vivo), ты подсоединяешь печень к специальному аппарату, который будет непрерывно прокачивать кровь через печень вне тела. Соединяешь все сосуды печени и возобновляешь кровообращение, что имитирует процесс пересадки печени пациенту.
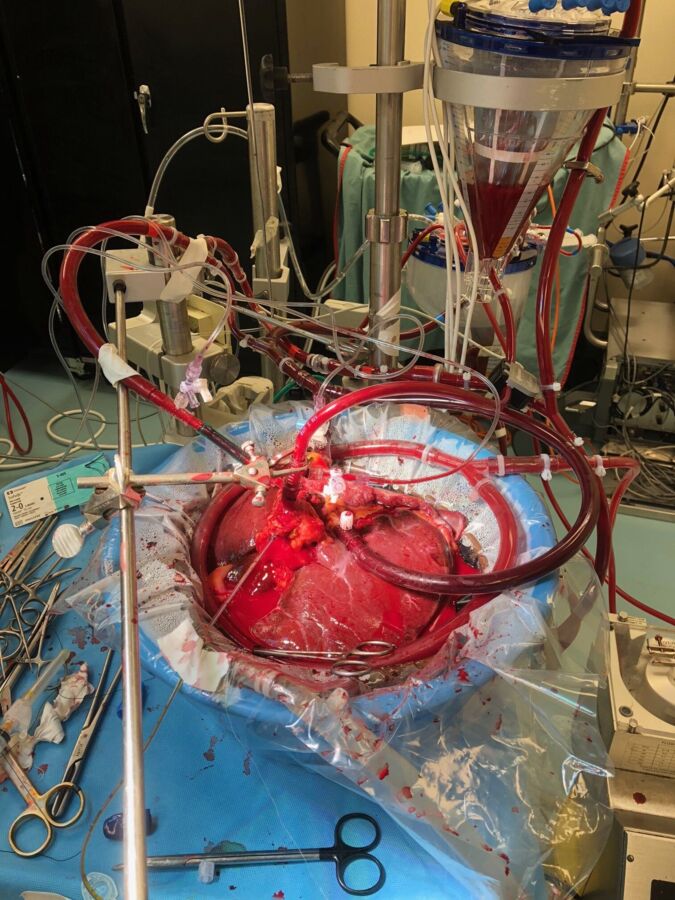
У перфузии ex vivo есть ряд преимуществ. Основное — значительное сокращение «времени холодовой ишемии». Это означает, что орган проводит гораздо меньше времени в холодной температуре, что лучше для сохранения его функциональности. В то же время, пока орган «перфузируется» на аппарате в нормальной температуре и с достаточным снабжением кислорода и питательных веществ, мы можем лучше оценить его функциональность до того, как он будет имплантирован пациенту. Донорская печень с различными поражениями не соответствует критериям трансплантации, и ее невозможно пересадить нуждающемуся пациенту. Такую печень подключают к перфузионному аппарату и начинают ее лечить, модифицировать и наблюдать. Например, если печень от донора с остановкой кровообращения, мы знаем, что есть закупоренные тромбами сосуды, и во время перфузии такой печени мы используем препараты для снижения спазма сосудов, «растворяющие» тромбы и борющиеся с воспалением. Или, например, если это печень с жировым гепатозом, мы можем применять препараты, улучшающие метаболизм, и так снизить депозит жира в гепатоцитах. Все эти манипуляции проводятся с целью «оживить» печень и сделать пригодной для трансплантации.
Также перфузия ex vivo увеличивает время нахождения органа вне тела, что приводит к удлинению так называемого «рабочего окна» — времени до трансплантации органа от донора к реципиенту. У врачей увеличивается время для доставки органа в нужное место для проведения трансплантации или же подбора и подготовки подходящего реципиента. Таким образом, у пациентов, ожидающих трансплантацию, повышается вероятность получения жизненно необходимого органа.
Экстракорпоральная перфузия печени (Ex vivo machine perfusion) — одно из новых направлений в трансплантации, применяемое для улучшении качества трупной печени, что ведет к увеличению количества доступных органов для трансплантации. В 2017 году в Европе начали проводить первые исследования на животных, а в 2018 году в Великобритании появился первый аппарат для клинических исследований. В 2019 году в США успешно прошло первое клиническое исследование с использованием аппарата для перфузии печени, но в связи с пандемией COVID-19 получение разрешения для данного аппарата от Американского управления по контролю за продуктами и лекарствами (U.S.Food and Drug Administration, FDA) было отсрочено на неопределенный срок.
Еще одним направлением, которым я занимаюсь, являются метаболические процессы, происходящие в печени во время трансплантации. В коллаборации с японскими коллегами мы пытаемся определить белки, которые могут быть использованы как прогностические сигналы. Эти биомаркеры помогут оценивать жизнеспособность органа при его хранении в холодном растворе или же во время ex vivo перфузии. Это облегчит работу врачей-трансплантологов при принятии решения о пригодности органа для трансплантации.
В Японии важно уметь работать в коллективе, в США — ты должен уметь демонстрировать свои навыки и создавать новые идеи
К моменту окончания докторантуры я начал задумываться о продолжении своей научной работы по изучению перфузии печени. Мне было интересно посмотреть на работу западных медицинских учреждений, занимающихся трупной трансплантацией печени с использованием метода ex vivo перфузии печени. После защиты докторской диссертации в Японии я получил приглашение работать в качестве исследователя в Научно-исследовательском институте им. Томаса Старзла, Университете Питтсбурга, США. Там передо мной поставили задачу о создании лаборатории по разработке и внедрению метода Экстракорпоральной перфузии печени (ex vivo machine perfusion).
В первый год работы основное время занимали организационные вопросы, такие, как закупка реагентов, аппаратов, налаживание контактов с различными биотехнологическими компаниями. На этом этапе сразу стала видна разница в организации рабочего процесса в Японии и США. В Японии развит дух коллективной работы, чувство преемственности поколений, поэтому старший покажет, научит младшего, при необходимости всегда есть, на кого положиться. Как в работе, так и повседневной жизни, общество в США ориентировано на индивидуальность, поэтому всему необходимо обучаться самостоятельно. В японских научно-исследовательских лабораториях четко организован логистический процесс. Если вам необходим реагент или инструмент для работы, вы отправляете электронный запрос в специализированную компанию, которая доставит всё, что вы заказали, в самое ближайшее время. Компании, выпускающие оборудование, предоставляют его для тестирования. Например, вы можете поработать на микроскопе последней модели в течение 3-4 недель, и, если он вам не подходит, вернуть его обратно. В США процесс построен иначе, надо сначала оплатить любые реагенты и инструменты, и только потом появится возможность их апробации. Хоть и были свои трудности в организации лаборатории, но для меня это был очень полезный и необходимый организаторский опыт.
Наряду с организаторскими вопросами, я приступил непосредственно к лабораторным исследованиям. Используя печень крыс, мы имитируем модель ишемии печени, которая схожа с донорской печенью от пациента с остановкой кровообращения (DCD liver) в клинической практике. Мы использовали модель, максимально схожую с клиническим течением патологического процесса у человека, то есть, печень проходит все этапы от снижения давления (процесс ишемии уже наступил) и агонии до остановки сердца, которая сопровождается выделением гормонов стресса и полным дисбалансом метаболических процессов. Сейчас мы имеем предварительные результаты применения данной методики на крысах, в скором времени собираемся опубликовать их в одном из научных журналов. Следующий этап — запустить проект по применению ex vivo перфузии печени в доклинических и клинических исследованиях.
Я уверен в том, что в скором будущем этот метод станет доступен для широкого применения, что значительно облегчит задачу врачей-трансплантологов, координаторов, реаниматологов и всей службы, задействованной в этом сложном процессе, а также обеспечит здоровым органом нуждающегося пациента.
О трансплантации органов и посмертном донорстве
По статистике, в Казахстане 80% трансплантаций приходится на пересадку органа от родственных доноров, 20% — от посмертных доноров.
Согласно статье 210 и пунктам 1 и 3 статьи 212 Кодекса РК от 7 июля 2020 года «О здоровье народа и системе здравоохранения» донором может быть живой человек (прижизненный донор) и умерший (посмертный донор).
В США и Японии при получении водительских прав человек отвечает, хочет ли он посмертно стать донором органов. И это нормальная практика для многих развитых стран. В Казахстане основной проблемой является низкая осведомленность населения о важности этого вида лечения. Также существует недоверие народа к медицинскому персоналу. Это и порождает различные мифы и недопонимание. Министерству здравоохранения необходимо проводить разъяснительную работу о развитии трансплантации, на доступном языке рассказывать о том, что это может спасти жизни людей.
В таких мусульманских странах, как Саудовская Аравия, Турция, Египет, где население преимущественно исповедует ислам, трансплантация органов проводится как стандартная процедура, причем на очень высоком профессиональном уровне.
Еще одной немаловажной, на мой взгляд, проблемой является отсутствие доверия к власти, к медицинским работникам. Необходимо поднимать заработную плату и социальный статус медицинских работников. Если будет достойная заработная плата, статус медицинского работника, а также конкурентоспособность специальности поднимется. Любой здравомыслящий человек будет стараться узнать больше, чтобы делать свою работу качественнее. А если нет достойной отдачи от работы, легко «выгореть» и потерять желание развиваться.
Казахстанская наука: пациент скорее жив или мертв?
Я всегда оптимистичен насчет Казахстана и отвечу, что скорее пациент ЖИВ! Но для того, чтобы он не только был жив, но и здравствовал, должны измениться многие параметры. Например, вопрос подготовки научных кадров. В США студенты, еще будучи бакалаврами медицинской школы, начинают участвовать в научных проектах и публиковать статьи. При прохождении конкурса на резидентуру у некоторых выпускников может быть до 50 публикаций! Если студентов увлечь наукой, то к окончанию университета у них будет достаточно опыта в проведении научных экспериментов, статистической обработке данных и написании статей. Необходимо отметить, что немаловажную роль в приверженности студентов к науке играет не только наличие ментора, но и финансирование, что влияет на оснащенность лабораторий и организованность всего процесса проведения исследований. Я давно не был в Казахстане, но думаю, что, как и во всех сферах, в медицине есть положительные изменения. В свою очередь, я с удовольствием помогаю своим коллегам и молодым специалистам, когда они обращаются с вопросами.
Данная публикация стала возможной благодаря помощи американского народа, оказанной через Агентство США по международному развитию (USAID) в период с 05.03.2021 по 04.07.2021, и был подготовлен в рамках «Центральноазиатской программы MediaCAMP», реализуемой Internews при финансовой поддержке USAID. Проект «Gylym Faces» несёт ответственность за её содержание, которое не обязательно отражает позицию USAID, Правительства США или Internews.
Поддержите журналистику, которой доверяют.